FOTOTECA
BIBLIOTECA
Ehrlichiosis Monocítica Canina
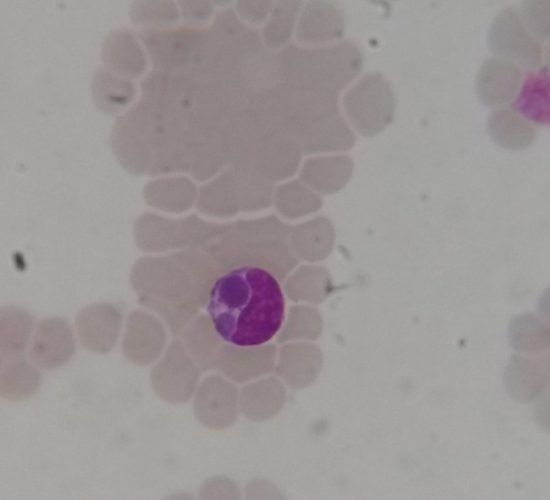
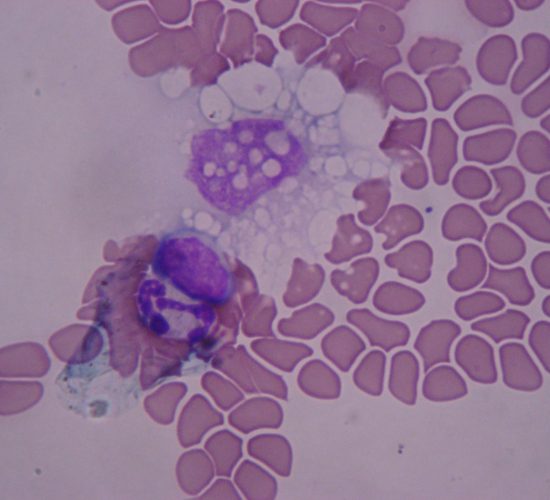
La ehrlichiosis monocítica canina (EMC) es producida por un microorganismo intracelular obligado denominado Ehrlichia canis. Este agente es una pequeña bacteria cocoide, pleomórfica y gram-negativa, que se presenta de manera intracitoplasmática en monocitos y macrófagos, en los que forma agrupamientos denominados mórulas. La infección tiene distribución mundial y es transmitida por Rhipicephalus sanguineus. El microorganismo se multiplica por fisión binaria dentro de vacuolas en los fagocitos mononucleares. La ruptura de las células infectadas deriva luego en la infección de nuevas células e inflamación de los tejidos afectados. La respuesta inmune del hospedador produce además alteraciones inmunopatológicas con producción de daño en múltiples órganos y tejidos. La EMC es una enfermedad multisistémica para la que se han establecido 3 fases: aguda, subclínica y crónica, basadas en la aparición cronológica, signos clínicos y anormalidades clínico-patológicas. Los signos clínicos en la fase aguda ocurren de 8 a 20 días post-infección. Las manifestaciones varían considerablemente entre perros, de acuerdo con la cepa del patógeno actuante, la respuesta inmune del hospedador, el estadío de la enfermedad y la presencia de coinfecciones con otros patógenos. Los signos clínicos más comunes son letargia, inapetencia, fiebre y pérdida de peso. La replicación de los microorganismos en los tejidos linfoides está asociada a linfadenopatía generalizada y esplenomegalia. Puede ocurrir descarga óculo-nasal, edema periférico y, con menor frecuencia, hemorragias petequiales y equimosis en piel y mucosas debido a la trombocitopenia y la disfunción plaquetaria. Los signos neurológicos pueden aparecer como resultado de la inflamación o la hemorragia en meninges. Las alteraciones hematológicas en esta fase incluyen: anemia no regenerativa, trombocitopenia, proteinuria y, ocasionalmente, leucopenia leve. Los perros pueden recuperarse de manera espontánea en 2 a 4 semanas. Es posible que los perros no tratados y los tratados en forma inapropiada ingresen en la fase subclínica, que puede durar meses o años. En esta fase, los animales se ven saludables, sin embargo, es posible que el recuento plaquetario permanezca en niveles inferiores a los rangos de referencia.
Los perros pueden ser portadores del patógeno de por vida, recuperarse de manera espontánea, o progresar hacia la fase crónica de la enfermedad. Esta fase se caracteriza por la presencia de alteraciones persistentes en el número de las células sanguíneas con diferentes grados de severidad. Generalmente hay nefropatía debido a glomerulonefritis, con pérdida de proteínas por depósitos de inmunocomplejos. Los hallazgos clínico-patológicos incluyen: anemia no regenerativa y trombocitopenia de manera frecuente y, en algunos casos, leucocitosis con neutrofilia y desvío a la izquierda. La mayoría de los caninos desarrollan linfopenia y, unos pocos, linfocitosis granular de moderada a marcada intensidad. También puede observarse hipoalbuminemia e hiperglobulinemia con gammapatía policlonal. La presencia de pancitopenia evidencia la forma crónica severa de la ehrlichiosis y es el resultado de una hipoplasia medular de todas las líneas celulares. La gravedad de los signos clínicos en esta fase es variable. Estos incluyen: letargia, inapetencia, hemorragias, palidez de mucosas, fiebre, pérdida de peso, linfadenopatía, esplenomegalia, disnea, uveítis anterior, desprendimiento y hemorragia retinal, poliuria-polidipsia y edemas. En algunos perros puede desarrollarse polimiositis que se manifiesta con pérdida difusa de la musculatura y tetraparesia. Las infecciones oportunistas secundarias pueden desarrollarse debido a mecanismos de inmunosupresión de diversa índole. Más raramente puede observarse plasmocitosis medular con gammapatía monoclonal, que puede derivar en un diagnóstico oncohematológico erróneo.
El diagnóstico de EMC puede realizarse por microscopía óptica a partir de extendidos sanguíneos coloreados, observando las estructuras morulares en los leucocitos mononucleares. Desafortunadamente la búsqueda de mórulas es exitosa solo en algunos casos, debido a que es una técnica dificultosa y que demanda mucho tiempo.
Adicionalmente se pueden observar las mórulas en extendidos de nódulos linfáticos y médula ósea. La técnica de inmunofluorescencia indirecta (IFI) para la detección de anticuerpos de tipo IgG contra E. canis es considerada la técnica “gold standard” para determinar la exposición al microorganismo. Los títulos iguales o superiores a 1:40 (IgG) son indicativos de exposición a E. canis. En infecciones agudas se recomienda analizar una segunda muestra con un lapso de 7 a 14 días para evidenciar seroconversión. En este caso, un aumento de 4 veces en los títulos de anticuerpos es sugestivo de una infección activa. Los anticuerpos del tipo IgG pueden permanecer detectables durante varios meses e incluso años después del tratamiento.
Las pruebas moleculares (PCR) son altamente sensibles para detectar el ADN de E.canis. En infecciones experimentales, la detección en muestras de sangre se puede lograr tan pronto como 4-10 días después de la inoculación.
Una vez finalizada la terapia de antibióticos, se deberá esperar de 4 a 8 semanas y se deberá realizar
una PCR con muestras de bazo o médula ósea para verificar la eliminación del microorganismo.
Piroplasmosis
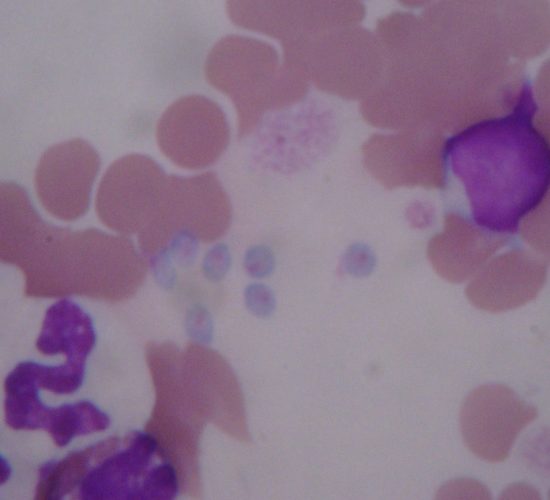
La piroplasmosis canina es una infección producida principalmente por protozoarios hemoparásitos de los géneros Babesia y Theileria, que afecta a los caninos domésticos y salvajes de todos los continentes. Es una enfermedad transmitida por garrapatas que afecta principalmente los eritrocitos y se caracteriza por producir fiebre, anorexia, anemia, trombocitopenia y esplenomegalia, llegando a ser fatal en algunos casos. La infección puede desaparecer o cursar de modo asintomático pasando a la cronicidad con un nivel mínimo de protozoarios circulantes. Se han reportado varias especies de Babesia y Theileria que afectan a los perros. Los protozoos pertenecientes a ambos géneros se multiplican asexualmente (merogonia) en los hospedadores vertebrados. En el género Babesia, esta multiplicación tiene lugar directamente en los glóbulos rojos mientras que en el género Theileria inicialmente se multiplican en los linfocitos circulantes.
En base al tamaño de los merozoítos intraglobulares se clasifican en “piroplasmas grandes” (>2,5 μm), que se corresponden con las especies B. canis, B. vogeli y B. rossi, y los “piroplasmas pequeños” (<2,5 μm) que se corresponden con B. gibsoni y B. conradae.
Hasta hace algunos años, los “piroplasmas grandes” eran consideradas subespecies de B.canis, aunque las marcadas diferencias a nivel molecular, especificidad de hospedadores y patogenicidad refuerzan la idea actual de que son especies diferentes. Este protozoario presenta formas intraglobulares pequeñas (<2,5 μm), ovales o circulares.
El ciclo de vida de Babesia spp. es indirecto. Los esporozoitos son inoculados al torrente sanguíneo de hospedadores vertebrados con mínimas cantidades de saliva durante la alimentación de una garrapata infectada. Después de invadir los eritrocitos, los esporozoitos se diferencian en trofozoitos que se dividen asexualmente (merogonia) en dos o más merozoitos. Eventualmente salen del eritrocito e invaden nuevas células, continuando con el ciclo de replicación en el hospedador. Unos pocos merozoitos detienen su división y se transforman en gamontes o pregametocitos. Las etapas de gametogonia y esporogonia tienen lugar en la garrapata. Cuando los gamontes son captados por una garrapata que se alimenta de un hospedador infectado, se diferencian a gametas (cuerpos radiales) en su intestino. La reproducción sexual ocurre cuando las gametas se fusionan para formar un cigoto diploide. Estos cigotos se dividen por meiosis dando lugar a ooquinetos haploides móviles que acceden a la hemolinfa invadiendo y continuando su replicación en varios órganos de la garrapata incluyendo las glándulas salivales. Luego de un ciclo final de multiplicación y diferenciación (esporogonia), los ooquinetos se transforman en esporozoitos (esporoquinetos), que infectan a nuevos hospedadores vertebrados. En algunas especies del género Babesia, los ooquinetos pueden alcanzar los ovarios de la garrapata hembra e infectar sus huevos. De este modo la infección puede transmitirse de una generación a otra. Este mecanismo se denomina
transmisión transovárica y tiene relevancia cuando la especie de garrapata que transmite la infección, desarrolla toda su etapa parasitaria en un mismo hospedador (e.g Rhipicephalus microplus en el ganado bovino). En el caso de R. sanguineus (cuyo desarrollo puede producirse en 3 hospedadores diferentes), el mecanismo de transmisión del agente se realiza de manera transestadial (de larva a ninfa o de ninfa a adulto). Las ninfas pueden transmitir la infección si se infectaron siendo larvas y los adultos si se infectaron siendo ninfas.
Las manifestaciones clínicas de la babesiosis canina varían según la especie del agente implicado y la presencia de coinfección con otros patógenos, además de la edad y el estado inmunitario del paciente. Babesia canis, transmitida por la garrapata Dermacentor reticulatus, causa una enfermedad leve a severa, cuya parasitemia es por lo general baja y no necesariamente se relaciona con la severidad de la enfermedad. Los signos clínicos en la fase aguda son fiebre, anorexia, ictericia, letargia y deshidratación. Entre las modificaciones clínico-patológicas podemos encontrar: trombocitopenia leve a severa, neutropenia e hiperfibrinogenemia. También puede observarse anemia normocítica y normocrómica no regenerativa, de magnitud leve a moderada y, en algunos casos, anemia hemolítica y hemoglobinuria.
Babesia vogeli, transmitida por R. sanguineus, usualmente se presenta de manera subclínica, pudiendo desarrollar una enfermedad leve a moderada en algunos perros. En los cachorros de 3 a 4 meses de edad, la presentación clínica de la enfermedad es más severa, pudiendo desarrollarse anemia hemolítica con desenlace fatal. Las alteraciones hematológicas más frecuentes son: trombocitopenia, leucopenia, leucocitosis, anemia no regenerativa y anemia hemolítica en cachorros.
Babesia rossi fue descripta hasta el momento solamente en Sudáfrica, Nigeria y Sudan, es transmitida por la garrapata Haemophysalis elliptica (syn. H. leachi). Los perros infectados con B. rossi pueden presentar manifestaciones clínicas que han sido categorizadas en dos formas de presentación, una no complicada y con bajo compromiso del sistema circulatorio (generalmente con buen pronóstico), manifestando fiebre, letargia, anorexia, membranas mucosas pálidas y esplenomegalia. Entre las anormalidades clínico-patológicas relacionadas con esta forma, puede haber anemia leve a moderada, trombocitopenia, leucocitosis, hiperbilirrubinemia y hematuria. La otra forma de presentación es la denominada complicada, en la cual se evidencia un compromiso importante del sistema circulatorio (con pronóstico malo). Esta forma se manifiesta con falla renal aguda (anuria), ictericia, hipotensión, síndrome de diestres respiratorio agudo, vómito, diarrea, pancreatitis, mialgia, ascitis, edema pulmonar, signos neurológicos y shock. Las anormalidades clínico-patológicas más frecuentes son: desequilibrio acido-base, azotemia renal, coagulopatías, anemia hemolítica inmunomediada, hipoglucemia e hipercalcemia. La elevada patogenicidad de B. rossi podría explicarse debido a la presencia de una fosfoproteína polimórfica localizada en la superficie de glóbulos rojos infectados, que se ha caracterizado y denominado recientemente BrEMA1 por sus siglas en inglés (Babesia rossi erythrocyte membrane antigen 1). A esta proteína se le atribuye la virulencia en la babesiosis canina por B. rossi ya que, en las especies menos patogénicas como B. canis y B. vogeli, no ha sido detectada.
Desde hace muchos años en el sur de Brasil, y más recientemente en Uruguay y en el noreste de Argentina se diagnostica frecuentemente en perros la infección con otro piroplasma de tamaño grande denominado Rangelia vitalii. Este parásito afecta, además de los eritrocitos, los leucocitos y las células endoteliales de los capilares sanguíneos, causando una enfermedad hemorrágica denominada namviubú (que significa orejas sangrantes en guaraní).
Entre los piroplasmas de tamaño pequeño, B. gibsoni se encuentra ampliamente distribuido a nivel mundial, siendo endémico en algunas regiones de Asia y EEUU, pudiendo transmitirse por la picadura de la garrapata R. sanguineus. Además, se ha resaltado la importancia de la transmisión horizontal mediante la inoculación de los parásitos mediante la mordedura en peleas de perros. En la babesiosis por B. gibsoni, son comunes las infecciones crónicas y la presentación puede ser subclínica o asociada a pérdida de peso y debilidad. En muchas regiones son comunes las infecciones subclínicas en los perros de raza Pit Bull Terrier debido al mecanismo de transmisión horizontal. Las manifestaciones clínicas más frecuentes incluyen fiebre, letargia, palidez de mucosas, ictericia, linfadenomegalia, esplenomegalia y pérdida de peso. Los hallazgos de laboratorio comprenden: anemia regenerativa (de tipo hemolítica inmunomediada), hiperbilirrubinemia, hemoglobinuria, bilirrubinuria y trombocitopenia.
Babesia conradae, descripta en California (EEUU), es una especie más virulenta que B. gibsoni, resultando en mayor parasitemia, anemia más marcada y mayor tasa de mortalidad. La enfermedad se caracteriza por presentar letargia, palidez de mucosas, vómitos y linfadenomegalia. Las alteraciones clínico-patológicas incluyen: anemia hemolítica inmunomediada y trombocitopenia.
Theileria annae (B. microti-like piroplasm) es un piroplasma pequeño descripto hace pocos años en el noroeste de España. Las manifestaciones clínicas más comunes reportadas en perros infectados son: debilidad, fiebre, letargia, taquicardia, taquipnea y hemoglobinuria. Las modificaciones hematológicas incluyen: moderada a severa anemia regenerativa, trombocitopenia, azotemia y proteinuria.
El diagnóstico de piroplasmosis puede realizarse de distintas maneras:
- observación directa de extendidos sanguíneos,
- pruebas serológicas y
- técnicas moleculares (PCR).
La detección de piroplasmas en los extendidos sanguíneos es la técnica de diagnóstico estándar. Este método es confiable en presencia de una moderada o alta parasitemia. El diagnóstico de infecciones crónicas o de caninos portadores sigue siendo un reto para la evaluación microscópica ya que las parasitemias bajas o intermitentes son de muy dificultosa observación aún para el profesional más entrenado.
Las técnicas serológicas pueden indicar una infección pasada o presente persistente. La inmunofluorescencia indirecta (IFI) para la detección de anticuerpos de tipo IgG, es la prueba serológica más comúnmente utilizada. Sin embargo, puede existir reacción cruzada entre las diferentes especies de Babesia.
Las técnicas moleculares (PCR) son más sensibles y se emplean frecuentemente en el diagnóstico específico de piroplasmosis. Resultan particularmente útiles para la detección de perros con parasitemia baja y para la identificación de las distintas especies.
Filariosis
La dirofilariosis canina en América es producida principalmente por el nematode. Dirofilaria immitis que, en su forma adulta, se localiza principalmente en las arterias pulmonares y en el ventrículo derecho de los perros infectados, produciendo un proceso denominado ‘‘enfermedad del gusano del corazón’’ (heartworm disease). El parásito es transmitido por mosquitos de los géneros Aedes, Anopheles y Culex. En general, y dependiendo de la región, la infección guarda relación con la raza, el sexo y la edad. La prevalencia suele ser mayor en machos y en perros de raza grande y pelo corto.
Respecto de la edad, los perros más afectados se encuentran entre los 4 y 8 años de edad, aunque puede ser diagnosticada eventualmente en perros menores de 1 año (pero mayores de 6 meses debido al período prepatente relativamente largo), así como en animales geriátricos.
El ciclo de vida de Dirofilaria immitis inicia cuando el mosquito se infecta al alimentarse con sangre de un perro con microfilarias circulantes (larva 1). Una vez ingeridas, las microfilarias migran desde el abdomen del mosquito a los túbulos de Malpighi donde desarrollan hasta su estado infectante de larva 3 (L3) en 10 a 14 días con una temperatura ambiente de 27°C. La L3 migra hasta las piezas bucales del vector y se encuentra lista para ser inoculada cuando el mosquito se alimente en otro hospedador.
Cada mosquito puede inocular entre 1 y 3 larvas por picadura. El desarrollo en el hospedador se inicia con las L3 en el tejido subcutáneo del perro, donde mudan rápidamente a L4. En los siguientes 50 a 70 días, las L4 permanecen en el tejido subcutáneo y entre las fibras musculares. La muda de L4 a pre-adulto (sexualmente inmaduro) ocurre alrededor de los 2 meses post infección (PI), para luego penetrar en una vena sistémica y ser transportados por el torrente sanguíneo hasta las arterias pulmonares donde se fijan. Durante los 3 meses siguientes, los pre-adultos maduran y alcanzan su localización final en las arterias pulmonares principales y las cavidades del corazón. La microfilaremia aparece entre los 6 y 9 meses PI.
Muchos perros diagnosticados como positivos mediante las técnicas de rutina a
menudo son asintomáticos. Los animales con la enfermedad clínicamente establecida muestran un historial con fatiga, dificultad para respirar o disnea durante el ejercicio, síncope, tos, hemoptisis, pérdida de peso, o síntomas de insuficiencia cardíaca congestiva (ICC). Los hallazgos en la exploración física pueden ser normales en pacientes con una enfermedad temprana o leve. El cuadro grave frecuentemente se asocia con pobre condición física, taquipnea o disnea, distensión o pulsaciones en la vena yugular, ascitis y otras evidencias de ICC del lado derecho.
Los caninos pueden verse afectados por otros filáridos como Dirofilaria repens,
Acanthocheilonema (syn. Dipetalonema) reconditum y A. dracunculoides. Los adultos de éstos filáridos se ubican en tejidos subcutáneos y cavidad peritoneal y liberan microfilarias que circulan en el torrente sanguíneo. Por este motivo, no basta con el hallazgo de microfiliaremia para el diagnóstico de dirofilariosis cardiopulmonar. Ante la sospecha clínica o ante el hallazgo hematológico de microfilarias circulantes, lo recomendable es realizar una correcta identificación de especie, debido a la importancia en la patogenicidad de Dirofilaria immitis.
El diagnóstico de filariosis puede realizarse por distintos métodos:
- búsqueda de microfilarias en “gota gruesa”;
- observación de microfilarias en el tubo de hematocrito microcapilar (Test de Woo);
- test de Knott modificado;
- método de filtración;
- detección de antígeno uterino de las hembras adultas;
- coloración histoquímica y
- estudios moleculares.
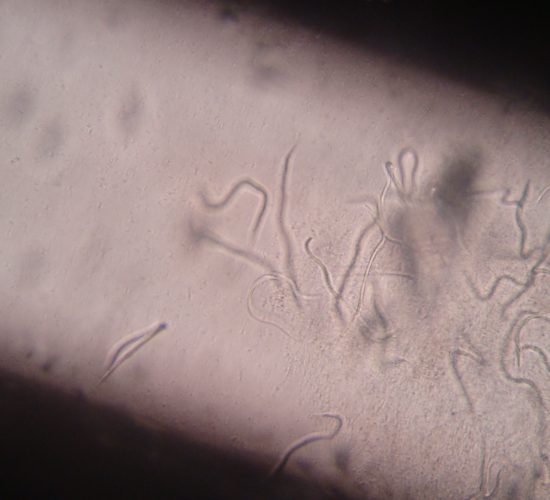
La observación de microfilarias en “gota gruesa”, es un método sencillo que se basa en la observación microscópica directa de una gota de sangre entre porta y cubreobjetos con el objetivo de 10x. Puede verse los movimientos de las microfilarias entre los eritrocitos. Por lo general, las microfilarias de Dirofilaria immitis son muy móviles, con movimientos ondulantes y no progresivos. Las microfilarias de Acanthocheilonema reconditum presentan movimientos rectilíneos y progresivos.
El test de Woo consiste en centrifugar la sangre con anticoagulante a 10000 rpm en un tubo capilar de microhematocrito (aprox. 80 µl) para luego observarlo al microscopio con el objetivo de 10x. Las microfilarias se observan fácilmente debido a su movilidad en la interfase entre la capa flogística y la fracción plasmática.
El test de Knott modificado consiste en producir la lisis de los eritrocitos de 1 ml de sangre con una solución de formol al 2%, con posterior centrifugación y observación del sedimento al microscopio. Se utiliza Azul de metileno como contraste. La muerte de las microfilarias con la solución formolada, confiere a los parásitos una morfología característica que puede utilizarse como orientación en la identificación.
El método de filtración se realiza mediante la destrucción o hemólisis de las distintas células sanguíneas de hasta 5 ml de sangre con una solución de carbonato sódico al 0,1%. Luego, se realiza la filtración del material a través de una membrana con poros de 3 µm de diámetro para concentrar y posteriormente teñir y observar las microfilarias al microscopio.
Estas últimas 2 técnicas, permiten la evaluación morfológica de las microfilarias y han sido usadas como referencia en muchas publicaciones. El hallazgo y observación de microfilarias con las técnicas antes mencionadas, debe complementarse con otras pruebas específicas para diferenciar las diferentes especies de filáridos que pueden afectar a los perros.
La detección de antígeno uterino se realiza por ELISA o Inmunocromatografía y consiste en la detección específico de antígenos circulantes eliminado por las hembras adultas de Dirofilaria immitis.
El método histoquímico, denominado también Test de fosfatasa ácida (FAC), se emplea para identificar la especie de filárido mediante el estudio de la distribución somática de actividad de fosfatasa ácida en las microfilarias circulantes.
Por último, las técnicas moleculares son más sensibles y se emplean para identificar a los distintos tipos de filáridos.
Hasta el momento, las infecciones asociadas a CVBDs en Guayaquil no han sido correctamente caracterizadas y reportadas, motivo por el que muchas de estas enfermedades infecciosas son usualmente sub-diagnosticadas o diagnosticadas de manera errónea. La EMC ha sido diagnosticada durante mucho tiempo por los veterinarios clínicos de la zona y parece ser la rickettsiosis de mayor relevancia en caninos del área urbana de la ciudad. Sumado a esto, en los laboratorios veterinarios es usual el hallazgo de estructuras tipo mórula en el interior de los leucocitos mononucleares (linfocitos y monocitos) (Olaya Martínez, observación personal). Por otro lado, los hallazgos hematológicos coinciden con la observación de piroplasmas intraeritrocitarios de más de
2,5 µm y se presume que el género Babesia se encuentra presente en la zona de estudio, aunque se desconocen las especies implicadas (Olaya Martínez, observación personal).
Por último, los casos de filariosis presentes en la zona de estudio son generalmente atribuidos a Dirofilaria immitis como agente causal, debido a la presencia de vectores competentes y del hallazgo periódico de microfilarias en los perros que, en general, se asocian a resultados positivos para la detección de antígeno específico de esta especie (Olaya Martínez, observación personal). Se desconoce la existencia de otras especies de filáridos en la zona.
Anaplasmosis canina
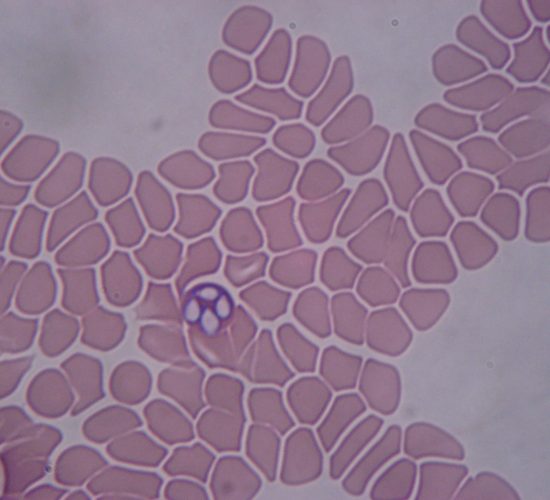
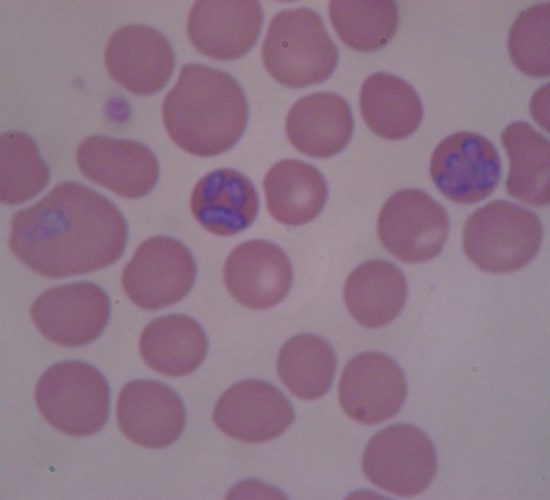
Anaplasma platys es un microorganismo clasificado en el género Anaplasma, familia Anaplasmataceae del orden Rickettsiales. Anaplasma platys es una bacteria intracelular gramnegativa, localizada en países de Europa, Asia y América del Sur, que provoca trombocitopenia cíclica infecciosa en perros, aunque también se han registrado casos de infección en gatos y ganado ovino. El ciclo biológico de este microorganismo implica un hospedador intermediario donde madura, generalmente garrapatas de los géneros Rhipicephalus y Dermacentor, que transmitirían la infección durante su alimentación. Es el único agente infeccioso intracelular descrito en personas o animales que infecta específicamente las plaquetas.
En los animales, la transmisión de Anaplasma platys a través de garrapatas, provoca una enfermedad clínica leve, cuyos síntomas más graves son fiebre, letargo, palidez de las membranas mucosas, hemorragias petequiales, epistaxis, y linfadenopatía. Al igual que con otras enfermedades transmitidas por garrapatas, la coinfección de Anaplasma platys con otros agentes infecciosos tales como Ehrlichia, Bartonella, o especies de Borrelia puede dar lugar a manifestaciones clínicas más intensas.
Por lo general, los signos clínicos se manifiestan entre 8 y 14 días después de la transmisión, apareciendo en el organismo plaquetas circulantes, lo que provoca una trombocitopenia grave, generalmente < 20.000 /μL. Los recuentos de plaquetas permanecen por debajo de 20.000 / μL de uno a dos días. Los organismos desaparecen rápidamente de la sangre periférica y aumentan los recuentos de plaquetas, alcanzando un valor normal en tres o cuatro días. Posteriormente, los organismos volverán a aparecer en un intervalo de 1 a 2 semanas, y el proceso se repite, lo que causa una trombocitopenia cíclica. El porcentaje de plaquetas parasitadas y la gravedad de los episodios trombocitopénicos disminuyen con los siguientes ciclos de parasitemia.
Pruebas recomendadas para el diagnóstico: El diagnóstico se basa en la identificación microscópica de agrupaciones de la bacteria intracelulares (mórulas) en las plaquetas de los frotis saguíneos, detección de anticuerpos
(ELISA), o métodos de diagnóstico molecular (PCR).
Parece existir cierta reactividad cruzada entre Anaplasma platys y Anaplasma phagocytophilum con el ensayo SNAP 4Dx. Con este ensayo, muchos animales infectados con Anaplasma platys tendrán resultados positivos para Anaplasma phagocytophilum. Los organismos están estrechamente relacionados y, evidentemente, comparten epítopos antigénicos que dan la reactividad cruzada en la pruebas de anticuerpos por ELISA. Sin embargo, los signos relacionados con la trombocitopenia son los que están asociados con la infección por Anaplasma platys.
Toxoplasmosis
La toxoplasmosis es una zoonosis de amplia distribución mundial producida por Toxoplasma gondii . La infección puede cursar con o sin sintomatología, lo que depende de factores asociados al parásito o al hospedador. La cantidad de parásitos que inician la infección pueden determinar el curso de la misma así como factores propios del hospedador, como la edad, el estado de las defensas, la gestación u otros.
Los taquizoítos miden de 3 a 5 micrómetros y tienen forma de medialuna, con el extremo anterior de forma conoidal y el posterior redondeado. Tiene un complejo apical constituído por anillos apicales y polares, conoide, roptrias y micronemas. Están recubiertos por una película, en su interior hay una mitocondria, microtúbulos subpeliculares, retículo endoplásmico, complejo de Golgi, ribosomas, retículo endoplásmico rugoso y liso, núcleo, gránulos densos, gránulos de amilopectina, y una organela similar a un plástido denominado apicoplasto.
La película está formada por tres membranas, un plasmalema y dos membranas aplicadas muy cercanamente que forman un complejo de membranas interno, el cual es formado por un mosaico de vesículas planas. La membrana interna es discontinua sobre el anillo polar anterior, en los microporos que están situados lateralmente y en el polo posterior, en el extremo posterior del parásito.
El anillo polar es un engrosamiento electrón-denso del complejo interno de membrana en la extremidad anterior que rodea un cono cilíndrico truncado llamado conoide que consiste de 6 a 8 elementos microtubulares. Los 22 microtúbulos subpeliculares se originan en el 2º anillo polar y corren longitudinalmente casi por todo el largo de la célula por debajo del complejo de membranas interno con una disposición en espiral suave. Los microtúbulos tienen estriaciones transversales prominentes. Entre el extremo anterior y el núcleo, hay 8 a 10 organelas con forma de bate llamadas roptrias.
Este protozoario del Phylum Apicomplexa vive dentro de una vacuola parasitófora, en el citoplasma de las células; en su ciclo, que es indirecto facultativo, intervienen los félidos como hospedadores definitivos y mamíferos y aves como hospedadores intermediarios.
En los hospedadores definitivos el ciclo es intestinal y extra intestinal. El ciclo intestinal ocurre en el epitelio entérico, la reproducción asexual es seguida por la reproducción sexual y la formación de ooquistes, que salen al exterior con la materia fecal. En el medio, con condiciones adecuadas, se forman en el interior de los ooquistes dos esporocistos con 4 esporozoítos cada uno, denominándose desde ese momento, ooquistes esporulados o maduros.
Durante el ciclo extraintestinal el parásito se reproduce asexualmente. Después de introducirse en el organismo, se multiplica en distintos tejidos; a ese estado, que se multiplica rápidamente, se le llama taquizoíto. Los taquizoítos destruyen las células parasitadas y se diseminan dentro del hospedador. Luego de un corto período, aparecen los bradizoítos que se multiplican mas lentamente, permanecen agrupados y rodeados por una membrana en los quistes tisulares, donde viven durante un tiempo indeterminado.
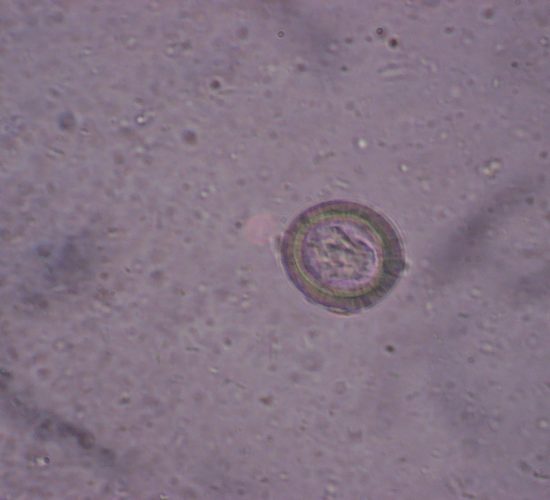
La transmisión natural de la toxoplasmosis se efectúa por vía oral o trasplacentaria, los estados infectantes son los taquizoítos, los bradizoítos y los esporozoitos Los gatos pueden infectarse por la ingestión de tejidos con taquizoítos, tejidos con quistes que contienen bradizoítos, ooquistes con esporozoítos, o por el pasaje de taquizoítos a través de la placenta
Si la infección se produce por esporozoítos (liberados de ooquistes ingeridos), el período prepatente puede variar entre 19 y 41 días y la producción de ooquistes puede ser muy escasa, durante un período patente corto, o no ocurrir.
Los gatos de una semana de edad y/o destetados, infectados con taquizoítos por vía digestiva, pueden enfermar y morir de toxoplasmosis ; o vivir y producir ooquistes con las heces después de un período prepatente de 19 días y durante 4 a 6 días. Si los gatos adquieren la infección al comer bradizoítos presentes en quistes tisulares, el período prepatente es de 3 a 10 días, el período patente de 10 a 30 días y se eliminan millones de ooquistes.
Los ooquistes sin esporular, refrigerados, permanecen viables al menos por 3
meses. Cuando están en el medio, a 22° C esporulan en 24 a 48 horas. Esporulados, almacenados a 4°C son infectantes por períodos de hasta 4 años y medio, entre 10 a 25 °C hasta 6 meses, estos períodos se acortan a medida que aumenta la temperatura; a 60° pierden su capacidad de infectar en 1 minuto. Aunque aparentemente no es frecuente, se ha comprobado experimentalmente que los gatos pueden volver a eliminar ooquistes después de una reinfección.
La infección puede ser adquirida tempranamente por vía trasplacentaria, lactogénica o si la gata lleva presas a sus crías. Posteriormente dependerá de las probabilidades de ingerir carnes crudas infectadas provistas por sus dueños o las presas que hayan capturado. Se considera que comienzan a cazar alrededor de los 3 – 4 meses, pero aquellos animales que no reciben alimento regularmente, como en el caso de animales abandonados, cazan para asegurar su subsistencia. El aumento de la prevalencia con la edad de la población indicaría que la infección temprana no es muy frecuente.
Para los hospedadores intermediarios el contacto con el suelo, donde están los ooquistes, se considera epidemiológicamente más importante que el contacto directo con los gatos.
Las cabras, ovejas y otros rumiantes que comen pasto pueden infectarse por ese
medio así como las aves que comen en la tierra. Cuando las condiciones ambientales son favorables y hay presas disponibles, la tasa de infección depende de la concentración de gatos en un área, que a su vez determinan la concentración de ooquistes en el suelo. La infección también puede adquirirse por el agua de bebida Ante la posibilidad de estar frente a un caso de toxoplasmosis (cuadros clínicos, hallazgos histopatológicos, etc.), individual o poblacional, es necesario efectuar el diagnóstico etiológico por medio de técnicas de laboratorio.
- Diagnóstico parasitológico: se utilizan técnicas para obtener y observar el parásito. En los preparados histológicos y las improntas no siempre se pueden observar los parásitos aislados. Los quistes tisulares, según el tamaño, se detectan más fácilmente. Sin embargo la observación del parásito no es suficiente para su identificación, ya que hay protozoarios morfológicamente similares, por lo que es necesario aplicar otras técnicas. Las técnicas de inmunohistoquímica (PAP, avidina-biotina) se utilizan para poner en evidencia a los parásitos pero son especialmente importantes para su identificación. Se aplican anticuerpos específicos sobre preparados histológicos de tejidos problema y luego
se revela la unión antígeno anticuerpo por medio de una reacción que colorea el producto de dicha unión. - Diagnostico Serológico: Se utilizan técnicas para detectar la presencia de anticuerpos contra Toxoplasma gondii que indican que hubo infección.
- Test de inmunofluorescencia indirecta (IFI): Es un test alta especificidad y sensibilidad. Se utilizan taquizoítos de la cepa RH como antígeno y sueros conjugados con isotiocianato de fluoresceína anti IgG o anti IgM de cada especie. Otras pruebas serológicas utilizadas son Test de hemoaglutinación indirecta (HAI) aglutinación de látex y ELISA en sus
distintos tipos La prueba de la reacción en cadena de la polimerasa (polimerase chain reaction: PCR) se aplica extensamente para detectar ADN del parásito, que confirman la infección en muestras de origen muy diverso (líquido amniótico, placenta, humor acuoso, tejido nervioso, carnes de consumo etc.El diagnóstico en el gato se puede realizar, durante el período patente, por la detección de ooquistes de Toxoplasma gondii mediante un examen de materia fecal y su inoculación en ratones Los ooquistes, de 9 x 12 micrómetros, no pueden ser diferenciados de los de Hammondia hammondi pero si de los otros coccidios de los gatos por su tamaño y morfología. La IgG se podrá detectar por IFI a partir de los 15 días postinfección en los gatos y que podría ser posterior a la finalización del pasaje de ooquistes, si la infección se produjo por la ingestión de quistes tisulares, pero si el origen de la infección fueran taquizoítos o
esporozoitos, el período prepatente es mas largo y por lo tanto la detección de IgG podría ser anterior al pasaje de ooquistes.